11.2022
Autor Dr. rer. nat. Markus Brüngel, Ernährungswissenschaftler
Die Erforschung der Darmmikrobiota (früher: Darmflora) hat in den letzten zehn Jahren einen starken Boom erfahren. In der Pädiatrie stehen neben therapeutischen Effekten der Darmmikrobiota vor allem präventive Fragen im Vordergrund.
Die initiale Besiedlung – neue Erkenntnisse
Veränderungen in der Schwangerschaft
Warum ist die Darmmikrobiota so bedeutsam?
Welche Faktoren beeinflussen die Darmmikrobiota?
Muttermilch – die beste Nahrung für den Säugling
Die initiale Besiedlung – neue Erkenntnisse
Von großer Bedeutung ist die Etablierung einer gesunden Darmmikrobiota insbesondere für junge Säuglinge. Sie unterstützt das unreife Immunsystem und trainiert es für seine Aufgaben. Lange Zeit ging man davon aus, dass die Geburt den Startschuss für die initiale Besiedlung gibt. Es ist hinlänglich bekannt, dass Säuglinge beim Durchtritt durch den Geburtskanal mit Vaginal- und Rektalkeimen der Mutter beimpft werden. Diese Keime findet man auch später im Darm der Säuglinge wieder. Neuere Forschungsdaten weisen allerdings darauf hin, dass der erste Kontakt mit Bakterien bereits sehr viel früher, nämlich im Mutterleib, passiert. In verschiedenen Studien konnten Bakterien bzw. deren DNA bereits im Fruchtwasser, in der Plazenta, im Nabelschnurblut, im Mekonium und sogar in der Follikelflüssigkeit nachgewiesen werden (DiGiulio et al. 2008; Jiménez et al. 2005 & 2008; Satokari et al. 2009; Pelzer et al. 2013). Nach dem heutigen Wissensstand müssen wir also davon ausgehen, dass wir vom Beginn unseres Lebens an – d. h. ab der Konzeption – mit Bakterien konfrontiert sind.
Veränderungen in der Schwangerschaft
Das mikrobielle Umfeld ändert sich aber nicht nur für Säuglinge, auch bei der Frau treten während der Schwangerschaft Veränderungen auf. Bestimmte Bakteriengattungen nehmen vom ersten bis zum dritten Trimester deutlich zu (Koren et al. 2012). Auch in der Vagina kommt es zu Veränderungen der Mikrobiota. Die Zahl an Laktobazillen nimmt zu. Diese produzieren Milchsäure, was zur Absenkung des pH-Wertes führt und damit ein ungünstiges Milieu für pathogene Keime schafft. Dies schützt zum einen vor aufsteigenden Infektionen (und senkt damit das Risiko für eine Frühgeburt), kann aber auch als Vorbereitung für die Geburt interpretiert werden, um dem Fötus einen optimalen „Bakteriencocktail“ bei der Geburt mitzugeben (Prince et al. 2014).
Warum ist die Darmmikrobiota so bedeutsam?
Für die volle Leistung des Immunsystems muss dieses erst „trainiert“ werden. Genau diese Aufgabe übernimmt die Darmmikrobiota.
- Positive Bakterien im Darm stellen eine natürliche Barriere gegenüber Fremdkeimen dar, d.h. sie besetzen Rezeptoren an den Darmepithelzellen, die dadurch für pathogene Keime nicht zugänglich sind. Des Weiteren produzieren sie Substanzen mit bakteriostatischer und/oder bakterizider Wirkung.
- Durch die Verstoffwechselung von unverdauten Nahrungsresten produzieren manche Stämme, wie z. B. Laktobazillen, Milchsäure. Diese senkt den pH-Wert im Darm ab und sorgt damit für ein ungünstiges Milieu für pathogene Keime.
- Darmbakterien unterstützen die Reifung des darmassoziierten Immunsystems (GALT – gut associated lymphatic tissue) und sorgen für die Erhöhung und die Differenzierung von Immunzellen im Darm. Das Immunsystem baut so eine Toleranz gegenüber ungefährlichen (kommensalen) Bakterien auf.
Es mehren sich die Hinweise darauf, dass eine Dysbiose, ein Ungleichgewicht der Darmmikrobiota, langfristig negative Folgen für die Gesundheit haben kann. Genannt werden hier höhere Risiken für Übergewicht, Allergien, Diabetes, Darmerkrankungen, Infektionen sowie sogar Angstzustände und Depression (Collado et al. 2012; Houghteling & Walker 2015).
Welche Faktoren beeinflussen die Darmmikrobiota?
Besonders die frühen Einflussfaktoren prägen die Entwicklung der Darmmikrobiota nachhaltig.
- Schwangerschaft: Mütterliche Mikrobiota, der Gesundheitsstatus der Mutter sowie ihr Lebensstil.
- Geburt: Vaginal geborene Kinder weisen gegenüber per Sectio geborenen Kindern eine deutlich bessere Darmmikrobiota auf. Bei per Sectio entbundenen Kindern lassen sich mehr Haut- und Krankenhauskeime nachweisen (Dominguez-Bello et al. 2010). Dementsprechend wird das Risiko für spätere Erkrankungen bei per Kaiserschnitt geborenen Kindern als höher eingeschätzt (Cho & Norman 2012). Da üblicherweise bei Sectio eine prophylaktische Antibiotikagabe der Mutter erfolgt, hat dies einen weiteren negativen Einfluss auf die Mikrobiota von Mutter und Kind.
- Ernährung des Kindes: Muttermilch ist auch in diesem Bereich als Goldstandard anzusehen, denn sie enthält u. a. probiotische Bakterien mit positiver Wirkung sowie präbiotisch wirkende Oligosaccharide.
Obwohl eine Kausalität noch nicht zweifelsfrei nachgewiesen ist, werden bereits verschiedene Maßnahmen diskutiert, um die Darmmikrobiota von per Kaiserschnitt geborenen Kindern zu verbessern. Eine Maßnahme ist das „Vaginal Seeding“, bei dem das Kind nach der Geburt per primärer Sectio mit Vaginalsekret an Mund, Gesicht und Körper benetzt wird.
Lesen Sie hierzu das Interview mit Prof. Henrich, Direktor der Frauenklinik Charité, in „Rundherum“ (2. Ausgabe 2016) zum Vaginal Seeding
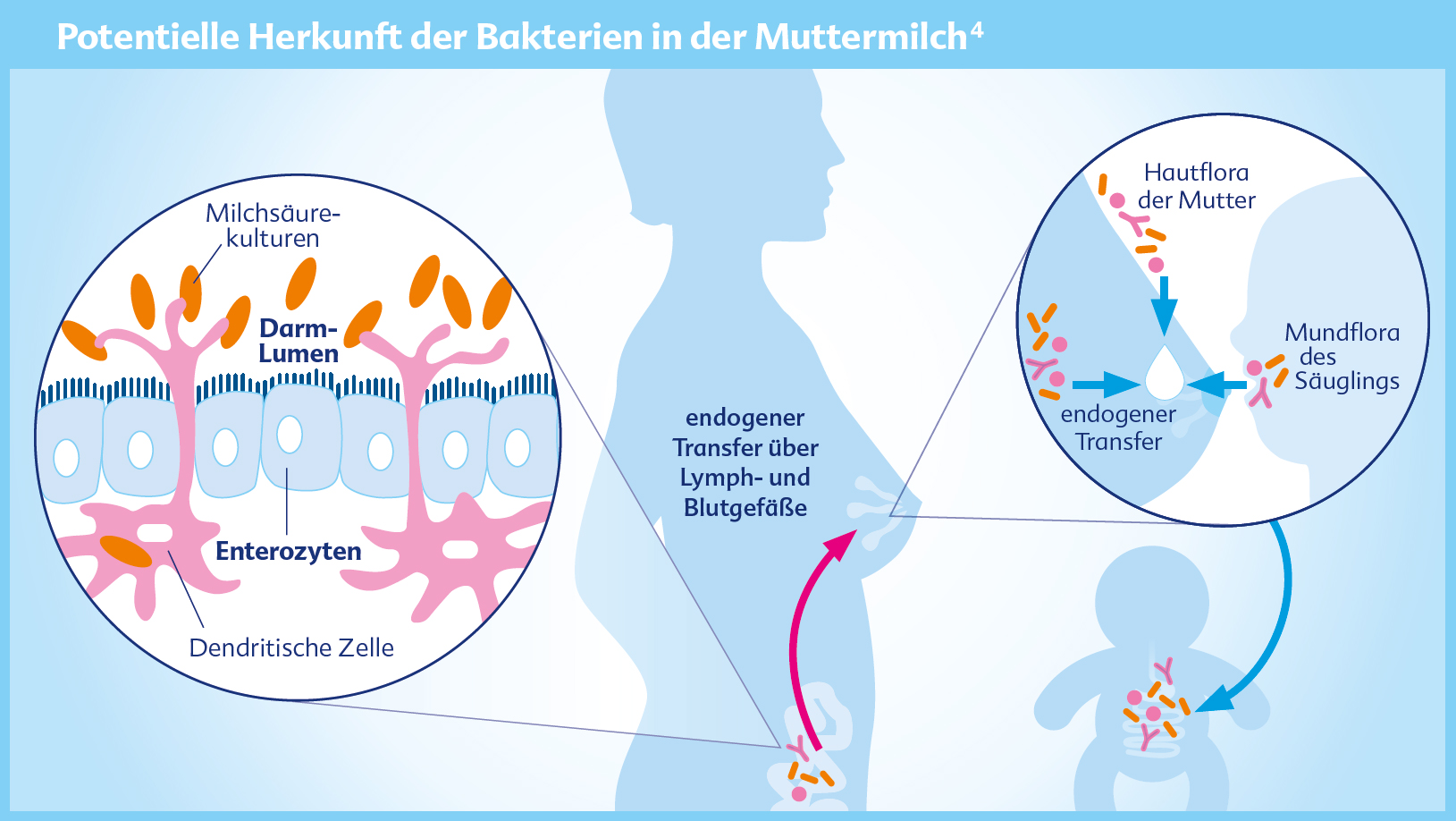
Muttermilch – die beste Nahrung für den Säugling
Dass Muttermilch eine Vielzahl von Bakterien enthält, ist noch eine relativ neue Erkenntnis. Sie passt aber in das Konzept, dass die Mutter ihre positive Mikrobiota an ihr Kind weitergibt. Die Besiedlung der Muttermilch mit den verschiedensten Bakterien erfolgt über unterschiedliche Wege, zum einen von außen über die Haut, auf der eine Vielzahl an Mikroorganismen leben. Über die Milchgänge gelangen die Keime in die Brust und damit in die Milch. Während des Stillens findet ebenfalls eine Übertragung von Keimen aus dem Mund- und Rachenraum des Säuglings in die Milch statt. Seit geraumer Zeit wird auch ein endogener Transfer von Bakterien aus dem mütterlichen Darm über das Lymph-Blut-System in die Muttermilch diskutiert. Dieser sogenannte „enteromammary pathway“ ist noch nicht zweifelsfrei nachgewiesen, stellt aber derzeit die gängige Hypothese dar (Fernandez et al. 2013; Jost et al. 2014). Gestillte Kinder erhalten demnach optimale Voraussetzungen für die Etablierung einer optimalen Darmmikrobiota.
Um nicht gestillten Kindern einen zumindest ansatzweise ähnlichen Vorteil zu verschaffen, gibt es inzwischen auch kommerzielle Säuglingsnahrungen, die mit Prä- und/oder Probiotika angereichert sind. Da vergleichende Untersuchungen fehlen, ist es entscheidend, welche Nachweise die Hersteller in klinischen Studien für Sicherheit und Nutzen ihrer Produkte zeigen konnten.
Für die HiPP COMBIOTIK® liegen mehrere Studien vor, die die Sicherheit des Produktkonzeptes mit Prä- und Probiotik (GOS + L. fermentum) kurz- und langfristig belegen (Maldonado et al. 2012; Gil-Campos et al. 2012; Maldonado-Lobón et al. 2015). Auch ein klinischer Nutzen dieser Nahrung konnte gezeigt werden: Im Vergleich mit der Kontrollgruppe hatten die Kinder mit HiPP COMBIOTIK® signifikant weniger gastrointestinale Infektionen (Maldonado et al. 2012, Gil-Campos et al. 2012). Speziell für per Kaiserschnitt geborene Kinder konnte gezeigt werden, dass eine Säuglingsnahrung mit dem probiotischen Keim L. fermentum CECT5716 gastrointestinale Infektionen um bis zu 73 % reduziert (Blanco-Rojo et al. 2022).
Literatur
Blanco-Rojo R et al. Front Pediatr 2022; 10:906924
Cho C & Norman M Am J Obstet Gynecol 2012; 208: 249-54
Collado MC et al. Gut Micr 2012; 3: 352-65
DiGiulio DB et al. PLoS One 2008; 3: e3056
Dominguez-Bello MG et al. Proc Natl Acad Sci USA 2010; 107: 11971-5
Fernández et al. Pharm Res 2013; 61: 1-10
Gil-Campos et al. Pharmacol Res 2012; 65: 231-8
Houghteling PD & Walker WA JPGN 2015; 60: 294-307
Jiménez E et al. Curr Microbiol 2005; 51: 270-4
Jiménez E et al. Res Microbiol 2008; 159: 187-93
Jost T et al. Environ Microbiol 2014; 16: 2891-2904
Koren O et al. Cell 2012; 150: 470-80
Maldonado et al. J Pedr Gastroenterol Nutr 2012; 54: 55-61
Maldonado-Lobón et al. Pharmacol Res 2015; 95-96: 12-9
Prince AL et al. Semin Reprod Med 2014; 32: 14-22
Satokari R et al. Lett Appl Microbiol 2009; 48: 8-12